Первичная желудочная лимфома – нечасто встречающаяся злокачественная опухоль, ее доля составляет менее 5% среди всех желудочных опухолей. В то же время это одна из самых распространенных экстранодальных лимфом, встречающаяся в 4- 20% случаев. Чаще всего желудочная лимфома поражает пациентов в возрасте свыше 50 лет, но бывают случаи, когда такое злокачественное новообразование встречается и в более раннем возрасте – на втором десятилетии жизни. Средний возраст пациентов, у которых заболевание начинает развиваться от 60 до 65 лет, причем у мужчин оно встречается в 2-3 раза чаще, чем у женщин. Некоторые исследования, проводимые в последние годы, показали, что заболеваемость желудочной лимфомой среди ВИЧ-инфицированных увеличивается и начинается в более молодом возрасте. [1]
Патофизиология
Злокачественная желудочная лимфома может развиться либо как первичная опухоль, возникшая в желудке, либо как метастаза, из лимфомы поразившей системный орган. Желудок – место, в котором лимфатические узлы метастазируют довольно часто, поэтому там и возникает вторичная лимфома желудка. Первичными обычно считают лимфомы возникающие и развивающиеся в желудочно-кишечном тракте, при которых симптомы заболевания локализуются на уровне ЖКТ нарушая его функции. В подавляющем большинстве случаев первичная желудочная лимфома развивается из слизистой или подслизистой оболочки MALT (mucosa-associated lymphoid tissue =слизистая оболочка лимфоидной ткани) в результате хронического воспаления вызванного бактерией Helicobacter pylori.
С точки зрения гистологии и иммуногистохимии желудочные лимфомы, развивающиеся из MALT обычно представляют собой неходжкинские В-клеточные лимфомы. Связь между хроническим гастритом вызванным Helicobacter pylori и лимфомой MALT была подтверждена обширными исследованиями в ходе которых было иммунологически продемонстрировано наличие Helicobacter pylori у большинства пациентов с лимфомой MALT. Существуют и другие типы лимфом затрагивающие желудок, но они не развиваются на MALT и встречаются реже. [4]
Гистологическая классификация
Гистологическая классификация лимфом зависит от степени ее злокачественности (т.е. от степени ее тяжести). Степень тяжести может быть малой, средней или высокой. Ниже представлена гистологическая классификация желудочно-кишечных лимфом, которые могут быть В-клеточными или Т-клеточными.
В-клеточные лимфомы: лимфомы MALT (в том числе с низкой и высокой степенью злокачественности), иммунопролиферативные злокачественные опухоли тонкого кишечника (низкой и высокой степени злокачественности), лимфоидный полипоз, лимфома Беркитта и берркитоподобные лимфомы.
Т-клеточные лимфомы желудка: Т-клеточные лимфомы ассоциированные с энтеропатией и Т-клеточные лимфомы неассоциированные с энтеропатией.
Большая часть желудочных лимфом с точки зрения гистологии – лимфомы с большими клетками, преимущественно В-клетками (В-лимфоциты). На их долю приходится примерно половина случаев первичных лимфом желудка. [5]
С точки зрения макроскопии желудочные лимфомы могут быть изъязвленными (с очаговыми, множественными или диффузными язвами), полиплоидными, гранулярными или инфильтративными. Наиболее распространенным считается язвенный тип лимфомы или его сочетание с другими типами.
Патанатомия
С точки зрения микроскопии низкозлокачественные лимфомы трудно отличить от псевдолимфом. Псевдолимфома характеризуется лимфоидной инфильтрацией слизистой оболочки и подслизистого слоя желудка и могут возникать у пациентов с хроническим гастритом и язвенной болезнью. Клинически и эндоскопически псевдолимфомы могут имитировать аденокарциномы желудка или лимфомы.
Паталогоанатомы дифференцируют псевдолимфомы от лимфом оп определенным гистологическим признакам, указывающим на изменения связанные со злокачественными новообразованиями (в том числе и лимфома), такими, например, как значительные лимфоэпителиальные поражения (лимфоидная инфильтрация желудочных желез и скриптов с их частичным разрушением), тельца Датчера и умеренная клеточная атипия. В случаях, когда дифференцирование между лимфомой и псевдолимфомой гистологически сделать не удается, исследование, для установления точного диагноза, может быть проведено с помощью иммуногистологических веществ, молекулярной биологии, полимеразно-цепной реакции (ПЦР).
Недавно проведенные исследования показали, что подавляющее число псевдолимфом на самом деле являются истинными низкозлокачественными лимфомами, поэтому от термина псевдолимфома лучше отказаться. [4]
По внешнему виду, выявляемом при эндоскопическом обследовании, большинство первичных опухолей желудка представляют эту форму. Поражение может происходить либо в виде тонкой гранулированной ткани, либо в виде инфильтрированной изъязвленной ткани. Эндоскопически дифференциация лимфомы и аденокарциномы довольно затруднительна, хотя лимфомы по сравнению с аденокарциномами имеют бОльшую тенденцию к росту и развиваются многоочагово, диффузно, вдоль слизистой оболочки. Желудочные лимфомы чаще всего поражают вход в желудок и тело желудка. В одном из исследований отмечено, что 46% лимфом располагались в теле желудка, кроме того отмечены случаи, когда в процесс был вовлечен весь желудок. Прогрессирующие лимфомы могут метастазировать и в области вне желудка, такие как центральная нервная система, кости, печень, почки, яичники и легкие. [1]
Клиническая картина
Первичная желудочная лимфома обычно имеет начальные болевые симптомы в области эпигастрия. Эти неспецифические симптомы, иногда приводят к отсрочке правильного диагноза в течение довольно длительного периода, который иногда может достигать нескольких лет. Некоторые признаки и симптомы лимфомы могут имитировать различные абдоминальные патологии, такие как язвенная болезнь, патология желчного пузыря, панкреатит или другие функциональные заболевания, а также другие типы желудочных новообразований.
Другими распространенными симптомами являются потеря веса, тошнота, рвота, абдоминальный метеоризм и частые расстройства желудка. Немного реже встречаются слабость мышц, ночное потоотделение, желтуха, лихорадка и дисфагия. Большинство пациентов поздно обращаются к врачу только потому, что симптомы заболевания неспецифичны, и они считают, что у них было расстройство желудка или открылась язва. Они впервые обращаются к врачу после того как симптомы, продолжающиеся длительное время уже становятся тревожными и представляют собой уже определенные осложнения лимфомы. 20-30% пациентов испытывают желудочно-кишечные кровотечения, такие как гематемезис или мелена (признаки кровоизлияния в верхней части ЖКТ). Реже у этих пациентов наблюдаются перфорация и обструкция желудка.
Физическое состояние у 55-60% пациентов в целом нормальное. При обследовании могут быть лихорадка, гепатомегалия (увеличение печени), спленомегалия (увеличение селезенки), желтуха и поверхностная лимфаденопатия. У 12% пациентов отмечается увеличение поверхностных лимфатических узлов. На более поздних стадиях заболевания добавляются признаки недоедания и существенного дефицита витаминов. [4], [1]
Диагностика
Клиническое обследование и радиология в целом неспецифичны.
Основными методами диагностики являются эзофагогастродуоденоскопия (эндоскопия верхней области пищеварительной системы) и биопсия опухоли. Если лимфома с низкой степенью злокачественности, то установить диагноз с помощью биопсии в начале заболевания не всегда представляется возможным, поскольку гистологические характеристики опухоли могут быть неспецифическими. Поэтому, чтобы установить окончательный диагноз, эндоскопия и биопсия проводятся повторно.
Показаны множественные биопсии слизистой оболочки в разных областях желудка, так как вид опухоли при эндоскопии может варьироваться: от незначительных изменений слизистой желудка до макроскопических повреждений. Эти макроскопические повреждения могут быть разными: отек слизистой оболочки, она может быть рыхлой и кровоточащей, на ней могут быть очаги эритемы и кровоизлияния, грануляционная ткань, контактное кровотечение, поверхностные эрозии, измененная форма и изъязвления. В случае клинических подозрений на злокачественность повторные эндоскопические биопсии являются обязательными, а первая считается неинформативной для точной диагностики. Кроме того, если есть возможность, выполняется эндоскопическая резекция пораженного участка слизистой, если он не очень большой по размеру и нет высокой вероятности риска кровотечения.
Быстрая эндоскопическая диагностика может быть произведена путем определения перегруппировок тяжелых цепей иммуноглобулина, которые бывают при лимфопролиферативных заболеваниях, при этом биопсийная ткань должна быть подвергнута ПЦР. Рекомендуется, чтобы образцы взятой на биопсию ткани гистологическому, иммуногистохимическому обследованию и генотипированию, чтобы диагноз был максимально полным и точным. [3]
Уточнить диагноз и определить степень поражения помогут обследования с помощью различных метолов медицинской визуализации (УЗИ, КТ, радиология и др.). Утолщение стенки желудка, наличие атипичных язв и деформации ткани, обструкция и др., указывают на злокачественный процесс в желудке при неспецифических симптомах лимфомы.
Компьютерная томография брюшной полости может выявить утолщение стенки желудка и изменения его полости в 85% случаев. В некоторых случаях при сканировании можно наблюдать типичные картины, демонстрирующие однородное утолщение стенки желудка, на которых можно различить лимфому и аденокарциному, являющуюся наиболее распространенным типом злокачественной опухоли желудка. При компьютерной томографии определяется три четверти низкозлокачественных инфильтративных или поллипоидных лимфом МАLT. Висцеральная лимфаденопатия обнаруживается у 50% пациентов.
Обычное ультразвуковое исследование брюшной полости может иметь значение для обнаружения опухоли в желудочно-кишечном тракте, но оно не является специфичным.
При магнитно-ядерном резонансе определяются такие особенности опухоли как неравномерность и утолщения складок слизистой, нерегулярная инфильтрация подслизистой оболочки, ограниченные констриктивные повреждения, рост экзофитных опухолей, брыжеечных масс и забрюшинная лимфаденопатия.
Экоэндоскопия является очень хорошим методом для определения степени и инвазии поражения. При исследовании этим методом возможна дифференциация лимфомы и карциномы на самых ранних стадиях заболевания. Но на поздних стадиях желудочные лимфомы и аденокарциномы этот метод менее информативен, так как оба типа опухолей имеют сходный вид.
Благодаря современным и разнообразным методам визуализации, применяемым сегодня, таким как эндоскопия ЖКТ, компьютерная томография, ядерно-магнитный резонанс и экоэндоскопия, пациенты все реже подвергаются открытым хирургическим или лапараскопическим операциям для диагностики опухоли. [4], [3], [5]
Стадии лимфомы желудка
După stabilirea diagnosticului de limfom gastric primar, stadializarea este esențială pentru planificarea tratamentului. Este foarte important de asemenea să se diferențieze limfoamele cu implicare strict a stomacului de cele care au metastazat și limfoamele primare de limfoamele secundare.
Procesul de stadializare începe cu o examinare endoscopică și cu biopsii repetate la diverse nivele ale tractului gastrointestinal care sunt apoi trimise la laboratorul de anatomopatologie pentru a se stabili gradul de infiltrare microscopică a peretelui și care sunt zonele afectate. Se prelevează biopsii inclusiv din duoden pentru a se stabili dacă tumora a ajuns până la acel nivel.
Al doilea pas în stadializarea limfomului gastric îl reprezintă efectuarea unei radiografii toracice pentru a se evidenția eventuala invazie pulmonară sau mediastinală.
Scanările computer-tomografice ale toracelui, abdomenului și pelvisului permit evaluarea invaziei ganglionare supra și subdiafragmatice și stabilirea extensiei tumorii la nivel sistemic.
Ecoendoscopia poate fi utilizată pentru estimarea atât a gradului de invazie în perete cât și a implicării ganglionilor limfatici regionali. Ecoendoscopia este superioară scanării CT cu privire la emiterea de rezultate fals negative. Examinarea măduvei osoase ajută la determinarea prezenței sau absenței invaziei tumorale în os.
Efectuarea unei laringoscopii este utilă pentru excluderea implicării inelului Waldeyer care este frecvent invadat de celule maligne la pacienții cu limfom gastric. [1]
Stadializarea limfoamelor gastrice în funcție de criteriile Musshoff este următoarea:
Stadiul IE — Limfom cu extindere limitată la nivelul stomacului.
Stadiul IIE1 — Implicarea stomacului și a ganglionilor limfatici învecinați
Stadiul IIE2 — Implicarea stomacului și a altor ganglioni limfatici subdiafragmatici.
Stadiul III — Invazia stomacului și a ganglionilor limfatici supradiafragmatici și subdiafragmatici.
Stadiul IV — Invazia pe cale hematogenă cu afectarea stomacului și a altor organe și țesuturi extralimfatice.
La aceste stadii se pot adăuga și următoarele prescurtări: E- invazie extranodală, S- invazia splinei, A- asimptomatic, B- simptomatic.
S-au folosit diferite sisteme de stadializare, cea mai folosită fiind stadializarea Ann Arbor a limfoamelor primare modificată de către Musshoff. [5]
Лечение
Tratamentul pentru limfomul gastric dispune de modalități multiple și nu există la momentul actual un protocol strict în ce privește aplicarea lor.
Opțiunile de tratament sunt însă în toate cazurile dependente de clasificarea histologică și de stadiul în care se află boala. Anumite centre recurg doar la chirurgie în timp ce alte centre sunt adeptele tratamentului non-chirurgical cu ajutorul chimioterapiei și radioterapie. [2]
Хирургическое лечение
Rezecția chirurgicală agresivă a tumorii este în momentul actual principalul tratament și cel mai utilizat, întrucât cu ajutorul chirurgiei se pot colecta mostre mari de țesut pentru analiza anatomopatologică, se explorează minuțios abdomenul, se reduce încărcătura tumorală prin excizii ample și este utilizată în scop curativ în cazul în care boala nu se află în stadiu avansat. La momentul actual se reconsideră efectuarea gastrectomiei radicale (exciziei complete a stomacului, splinei și a tuturor ganglionilor limfatici perigastrici) ca tratament de bază în limfom, aceasta nefiind considerată necesară în toate cazurile bolii. În stadiile inițiale ale bolii se poate reduce și la gastrectomie parțială.
Părerile sunt însă contradictorii. Anumiți autori prezintă gastrectomia totală ca tratament curativ chiar din stadiile inițiale ale bolii împreună cu excizia tuturor ganglionilor limfatici regionali în timp ce alți autori consideră că în stadiile IE și IIE poate fi efectuată și gastrectomia parțială sau tratament conservator cu chimioterapie și radioterapie, întrucât au fost obținute rezultate foarte bune în ce privește supraviețuirea la 5 ani în urma tratamentului conservator. Însă, la momentul actual tot chirurgia radicală este cea mai utilizată metodă de tratament, alături de tratamentul infecției cu Helycobacter pylori. [2], [4]
Mortalitatea și morbiditatea tratamentului chirurgical sunt similare cu cele înregistrate în urma aplicării tratamentului non-chirurgical (chimioterapie și radioterapie) pentru limfoamele gastrice în stadiile I și II. În aceste stadii nu este indicată chirurgia agresivă deoarece aceasta duce la creșterea morbidității și la scăderea dramatică a calității vieții pacientului după operație. La o rată de rezecabilitate a stomacului între 60 și 88% s-au înregistrat rate de supraviețuire la 5 ani între 50 și 87%. Chirurgia radicală a bolii avansate a fost asociată cu rate mai mare de morbiditate și mortalitate și rate mici de răspuns la tratament între 6 și 40%. Mortalitatea postoperatorie în cazul tumorilor avansate este între 3 și 25% și chirurgia paleativă având rate ridicate ale mortalității.
Chirurgia paleativă se face în scopul reducerii durerii pacientului și ameliorării simptomelor legate de masa tumorală precum și în vederea controlării hemoragiilor asociate cu alte tipuri de tratament. Se fac proceduri de rezecție parțială a tumorii și de hemostază.
Комбинированная терапия
Terapia multimodală ce combină rezecția chirurgicală a tumorii cu chimioterapia și ocazional cu radioterapia este acceptată ca modalitate principală de tratament în cele mai multe centre. Utilizarea ei a crescut simțitor rata de supraviețuire la 5 ani a pacienților diagnosticați cu limfom gastric. Chirurgia cu intenție de radicalitate asociată cu chimioterapie a determinat îmbunătățirea simțitoare a ratei de supraviețuire și a răspunsului la tratament comparativ cu utilizarea doar a chimioterapiei. Chimioterapia folosită în vederea îmbunătățirii rezultatului chirurgiei radicale și scăderii ratei de recidivă tumorală poartă numele de chimioterapie adjuvantă. Cele mai noi studii recomandă asocierea chirurgiei radicale cu chimioterapia adjuvantă ca tratament de primă intenție pentru limfoamele gastrice indiferent de gradul de malignitate. Un studiu chinez arată că utilizarea chimioterapiei postoperatorii determină creșterea ratelor de supraviețuire post-rezecție chirurgicală. Un studiu prospectiv realizat în Franța vine cu o estimare foarte optimistă, aproximând rata de supraviețuire postoperatorie la pacienții cu limfom cu grad înalt de malignitate care au fost supuși apoi chimioterapiei, iar mai apoi chimioterapiei adjuvante la 99-100%. Superioritatea chirurgiei combinate cu chimioterapia a fost observată în foarte multe studii, arătându-se că pentru stadiile IE și IIE terapia combinată crește șansele de supraviețuire la 86-94%. Ratele de supraviețuire sunt mai mari decât cele ale pacienților supuși exclusiv intervenției chirurgicale radicale, chimioterapia adjuvantă reducând foarte mult riscul de metastazare al tumorii deoarece în ciuda exciziei ei cu limite de siguranță oncologice, riscul existenței metastazelor microscopice în țesutul rămas neexcizat este încă ridicat. Terapia combinată, pe lângă faptul că crește rata de supraviețuire a fost asociată și cu o rată mult mai mică de recidivă și metastazare. [1], [4]
Stadiile inițiale ale bolii indiferent de tipul histologic pot fi controlate prin chimioterapie sau prin chimioterapie asociată cu radioterapie. Avantajul în aceste cazuri este prezervarea stomacului și evitarea morbidității și mortalității asociate cu chirurgia. Pe de altă parte chirurgia este singura modalitate sigură care poate asigura controlul bun al bolii din cauză că doar chirurgical medicul poate fi sigur că tumora a fost excizată și a dispărut complet. Prin urmare și în stadiile inițiale ale bolii se recurge la terapia combinată cu chirurgie și chimioterapie adjuvantă.
Un interes ridicat este alocat limfoamelor maligne MALT întrucât regresia tumorii a fost raportată în anumite cazuri în care s-a reușit eradicarea infecției cu Helicobacter pylori. Un studiu ce a cuprins 120 de pacienți cu limfom gastric MALT în stadiu incipient care au fost tratați cu terapie anti Helicobacter pylori ce a cuprins amoxicilină și omeprazol s-a raportat o rată de remisiune de 81%, alți 9% dintre pacienți având o remisiune parțială. Un alt studiu care a tratat 233 de pacienți cu antibiotic a raportat remisiune completă la 62% dintre aceștia și remisiune parțială la 12% după 6 luni. După 40 de luni de urmărire a acestor pacienți 13% au înregistrat recidiva limfomului gastric. Nu se cunoaște încă ce stadii ale limfomului gastric răspund la terapia de eradicare a Helicobacter pylori însă se crede că eradicarea acestui microorganism este o opțiune de tratament care trebuie luată obligatoriu în considerare.
Rezecția chirurgicală, radioterapia,chimioterapia și combinația acestora sunt toate modalități de tratament eficace. Radioterapia a fost încercată ca formă locală de tratament la un număr mic de pacienți, înregistrându-se o rată de supraviețuire de 93%. La acestea se adaugă terapia de eradicare a Helycobacter pylori cu antibiotice. [5], [1]
Прогноз
Limfomul gastric are un prognostic bun în următoarele condiții: limfom gastric cu grad mic de malignitate, pacienții cu vârsta sub 65 de ani, rezecția chirurgicală cu respectarea marginilor de siguranță oncologică și remisiune inițială completă a tumorii.
În boala avansată un prognostic bun poate fi atins în cazul în care limfomul gastric are un grad mic de malignitate și răspunde bine la chimioterapie și radioterapie. Prognosticul limfomului gastric este similar cu cel al limfoamelor extradigestive.
Stadiul bolii joacă de asemenea un rol foarte important în ceea ce privește prognosticul, alături de gradul histologic de malignitate. Este ușor de dedus faptul că o boală aflată într-un stadiu incipient va avea un prognostic mult mai bun comparativ cu cea în stadiul II sau III.
Ratele de supraviețuire la 5 ani sunt 91% pentru limfoamele cu grad redus de malignitate și între 56-73% pentru limfoamele cu grad înalt de malignitate.
În concluzie, datorită rarității foarte mari a limfomului gastric, foarte multe aspecte în ce privește stadializarea și mai ales tratamentul bolii sunt controversate și nu există un protocol de tratament bine stabilit pentru acest tip de limfom. De cele mai multe ori pacienții se prezintă la medic târziu, cu o boală în stadiu avansat însă metodele noi de diagnostic ajută la emiterea unui diagnostic corect chiar din stadiile incipiente. Majoritatea limfoamelor gastrice sunt de tip MALT. [3], [4]
Cel mai bun tratament pentru limfomul gastric nu a fost încă stabilit dar pentru boala avansată aflată în stadiu III sau IV, cea mai bună modalitate terapeutică se consideră a fi combinarea chimioterapiei cu radioterapia deoarece chirurgia este asociată cu o mortalitate și morbiditate semnificativă. Cea mai bună modalitate de tratament pentru limfoamele în stadiile I și II este rezecția chirurgicală completă a tumorii. Pentru limfoamele MALT se adaugă în tratament și eradicarea infecției cu Helicobacter pylori. Se așteaptă noi triajuri randomizate care să clarifice care dintre modalitățile de tratament, conservator, chirurgical sau combinat este mai eficace pentru tratamentul limfomului gastric localizat, fără metastaze. [5], [1]
Библиография
- Primary gastric lymphoma-Pubmed resources,
Link: http://www.ncbi.nlm.nih.gov/books/NBK6966/
- Mucosa- Associated Lymphoid Tissue- Medscape,
Link: http://emedicine.medscape.com/article/207891-overview
- Primary gastric lymphoma, Non-Hodgkins lymphomas-WebMd,
Link: http://www.webmd.com/cancer/non-hodgkins-lymphoma/lymphoma-gastric non-hodgkins-type
- The primary gastric lymphoma-surgical oncology net,
Link: http://www.surgical-oncology.net/lymphoma2.htm
- Pathogenesis and treatment- British Journal of Haematology,
Link: http://onlinelibrary.wiley.eom/doi/10.1111/j.1365- 2141.2006.06444.x/pdf
Клинический случай:
Pacient: D. G 57 ani S: masculin, mediu rural, fumător, grupa sanguină: A (II) Rh (+) pozitiv, internat Clinica Chirurgie ,, Constantin Țîbîrnă,, secția chirurgie aseptică a SCM „Sfânta Treime” 08.08.2017;
Acuze: inapetență, dureri epigastrale, vărsături postprandiale precoce, scădere ponderală (-20kg/2 luni), incapacitatea tranzitului alimentar (totală alimente solide, cu dificultate pentru lichide);
Diagnosticul la internare: Stenoza corpului gastric după administrare de substanță toxică (anhidrida);
21.06.-12.07.2017 internat în secția toxicologie cu diagnosticul: Intoxicație acută cu substanță corozivă. Combustie chimică a mucoasei tractului digestiv. Hemoragie gastrică Forest II-B;
FEGDS: Combustie chimică a mucoasei TD. Eso-gastrită necrotică totală. Hemoragie Forest II-B
FEGDS peste 2 luni: Esofagul normal. Gastrită chimică cu regenerare incompletă. Nu este posibil de pătruns în corpul stomacului cu aparatul. Stenoză subtotală a corpului gastric.
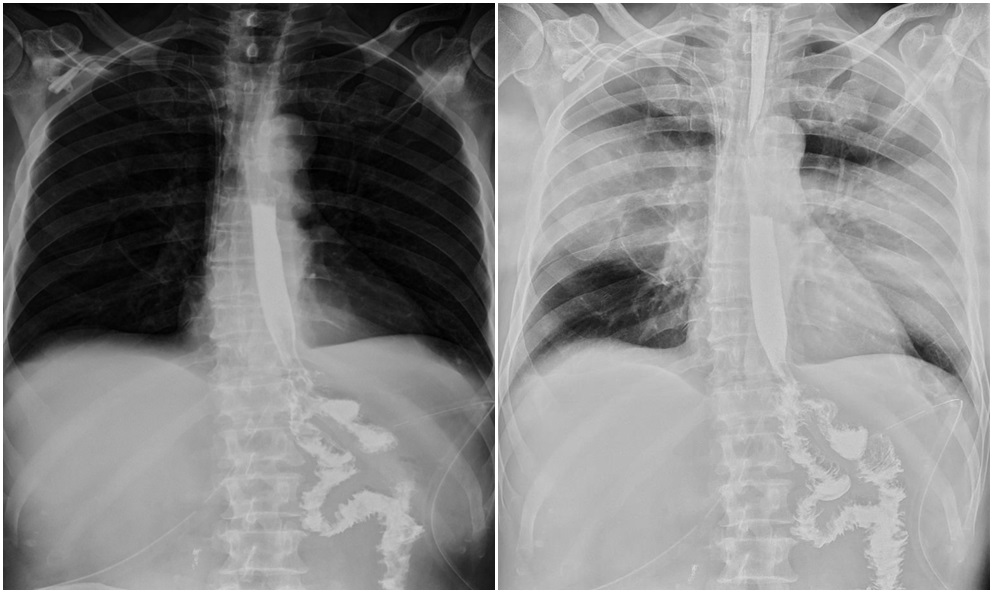
Radioscopia preoperatorie a tractului digestiv superior cu radiofarmaceutic (stenoză qwasitotală a corpului gastric):
Operație10.08.2017: Laparotomie medio-mediană. Gastrectomie totală cu eso-enteroanastomoză și entero-enteroanastomoză. Splenectomie. Dreanarea cavității peritoneale.
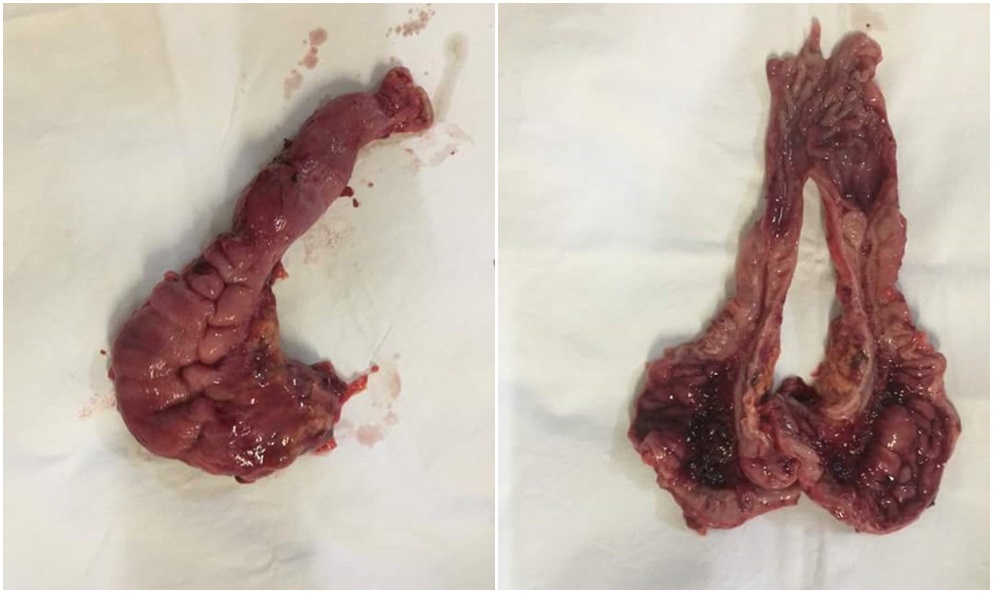
Macropreparat (integru, secționat):
Evoluție postoperatorie: A VI-a zi postoperator: Alterarea stării generale a pacietului. T- 38- 38,5 C. Semne de iritații peritoneale pozitive; 16.08.2017. Relaparotomie. Suturarea defectului (dehiscenței) peretelui anterior de anastomoză eso-jejunală. Sanarea si drenarea cavității peritoneale.
Diagnostic postoperator: Dehiscență a peretelui anterior a eso-jejunoanastomozei. Peritonită purulentă generalizată.
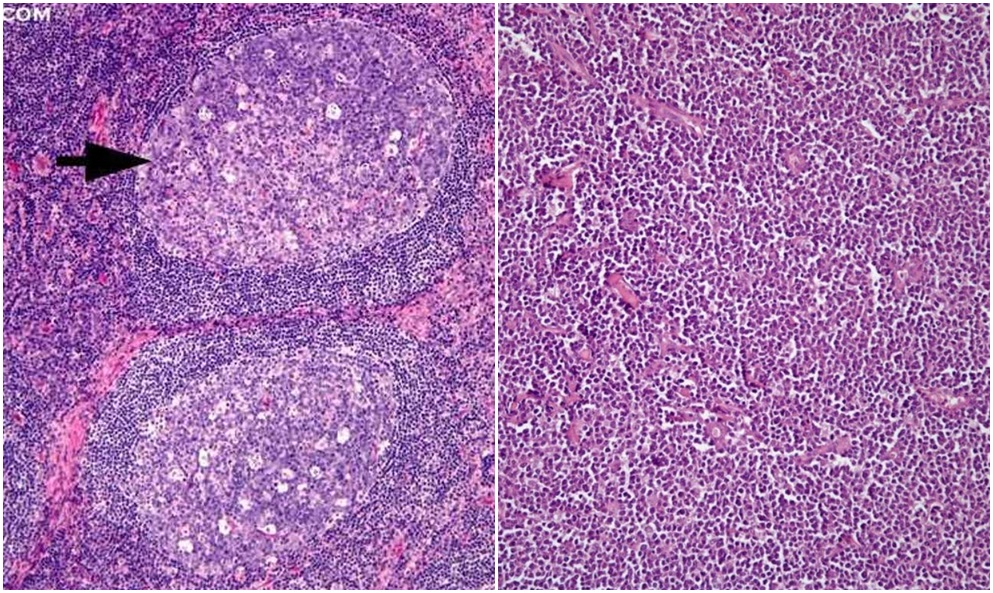
Concluzie patomorfologică: Gastrită hipertrofică cu focare de hiperplazie al epiteliului glandular. Intr-o serie de secțiuni sunt focare în care este pierdută arhitectonica normală a folicolilor limfoizi cu prezenta celulelor polimorfe atipice printre care prevalează celule limfocitare. Totodată se apreciază infiltrate celulare și la nivelul stratului submucos și muscular — suspecție la Limfom Non-Hodgkin. Urmează de a se determina histogeneza procesului patologic în cadrul Institutului Oncologic.
Radioscopia postopertaorie a tractului digestiv superior cu radiofarmaceutic (a 20-a zi postoperator cu tract digestiv reconstruit):
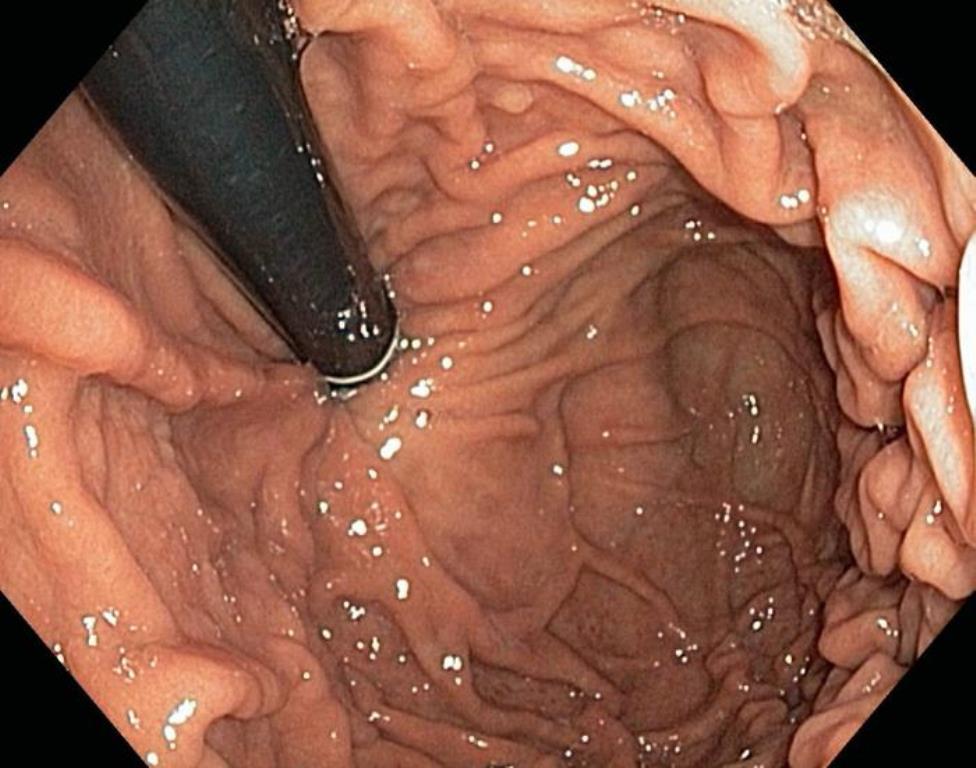
FEGDS (05.09.2017): esofagul permeabil. Anastamoza e liberă, permeabilă. Semne de stenoză sau malformație nu sunt.
Echipa operatorie:
Gheorghe STRAJESCU – conferențiar universitar, doctor în științe medicale, vice-director profil chirurgie a SCM „Sfânta Treime”;
Petru BUJOR – profesor universitar, doctor habilitat în științe medicale, șef Clinică Chirurgie ”Constantin Țîbîrnă”;
Alina BOTNARENCO – medic rezident chirurg;
Lilia ȚÎGANCIUC – sef secție Anesteziologie a SCM „Sfânta Treime”, medic-anesteziolog.